分化誘導療法と遺伝子

私たちの体の中では、DNAが傷ついたりすることによって、細胞が異常に増殖してしまうことがあります。それを放っておくと、がんになってしまいます。そんなとき活躍するのが、「がんを抑える遺伝子」。細胞の異常な増殖を抑える物質を作る働きを持っています。
私たちは、「がんを抑える遺伝子」を生まれ持っており、がんの発症を日々抑えてくれています。しかし、がん患者さんの場合、何らかの原因(生活習慣や加齢など)で「がんを抑える遺伝子」がクチャクチャに折りたたまれてDNAのスイッチがオフになり、がんを発症することがあると考えられています。スイッチをオフにする鍵を握っているのが、「DNAメチル化酵素」という物質です。
この「DNAメチル化酵素」をコントロールして、「がんを抑える遺伝子」のスイッチをオンに戻す。遺伝子治療にとって分化誘導療法は重要な治療方法になります。
分化誘導療法と遺伝子
正常細胞は未熟な状態から少しづつ成熟し、ある種の機能を果たしてから死滅するという一生を送ります。
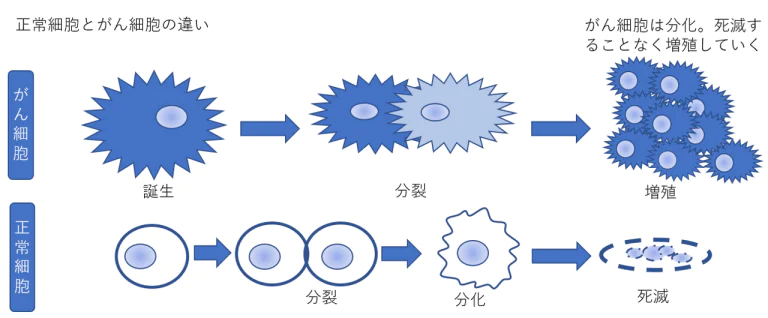
分化とは、分裂した細胞がそれぞれ役割を持った細胞に変化すること。分化するともう分裂をしない。 正常細胞の大部分が自死(アポトーシス)の道を選ぶのは、個体の生命を維持するため、つまり遺伝子の損傷に端を発して異常化する前に新しい細胞にバトンタッチ(新陳代謝)して全身に危害が及ぶのを未然に防ぐ生命維持機構なのです。 ところががん細胞は正常細胞に見られるようながんを抑える遺伝子の脱メチル化が起こりません。 遺伝子の脱メチル化を阻止しているのはメチル転移複合酵素の異常にあります。ここに注目しない限りがんの根本的治癒はあり得ません。
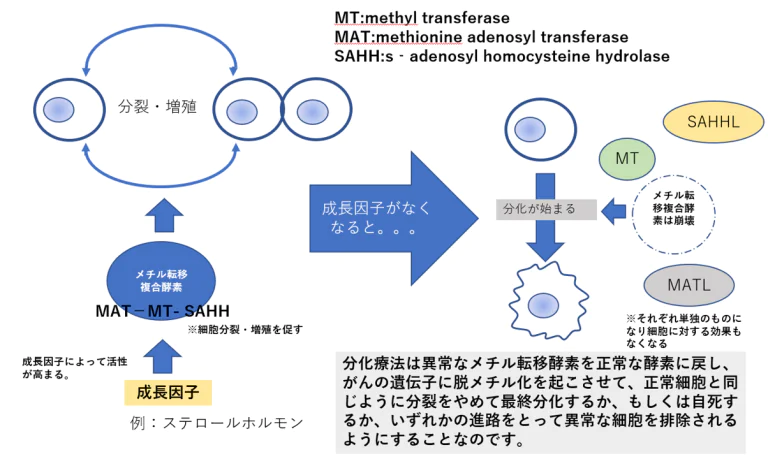
脱メチル基DNAの合成は細胞が分化するための重要なシステム
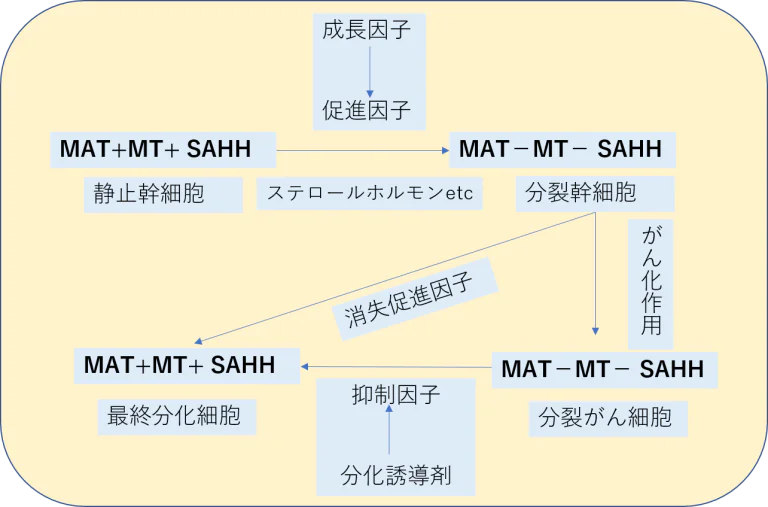
- 各器官や組織にはそれぞれ特殊な幹細胞がありこれらの幹細胞はある程度まで分化していますが、最終点まで分化していません。まだ分裂する能力を残しています。
- 最終分化に関する遺伝子はメチル基導入のために抑制された状態にあります。
- 成長因子が存在しないなどの条件が整いますとメチル転移複合酵素の活性が直ちに低下し、脱メチル基DNAを合成します。
- 脱メチル基合成は最終分化に関連する遺伝子にスイッチを入れて最終分化細胞を形成します。このような細胞はもはや分裂能力を持たなくなります。
リボソームの増産は細胞分裂の調整・制御を行うチェックポイント
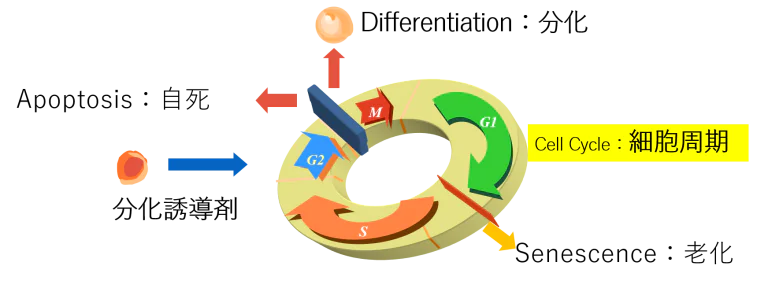
細胞分裂の際には、多くの関所を設けてサイクリン(Cyclins )に守らせて細胞分裂が順序よく行われるようにしています。
- メチル基はすべての有用部分に分布しており、もしこの部分のオーダーがメチル基を欠いているとその部分の有用オーダーも不要部分とともに分解されてしまいます。
- したがってメチル化が完全だと有用なリボゾームを生産し、不完全だとリボゾームを生産することができません。リボゾームの生産はメチル転移複合酵素の活性によって決まることになります。
- リボゾームの増産は、細胞がDNA合成に入る前の必須条件でリボゾームの増産がないと細胞はサイクリンやDNAの複製と細胞分裂に必要なタンパク質、核酸合成酵素、染色体タンパク、細胞構築用タンパクなどを提供できないのでDNAの合成ができません。
異常メチル化転移複合酵素はがんの中心的問題
- 正常なDNAメチル転移複合酵素の主な機能は母細胞DNAのメチル分布をコピーしますが、がん細胞のDNAメチル転移複合酵素は活性が異常に高いために新たに増加した過メチル化ばかりです。
- 過メチル化はがん抑制遺伝子やDNAの修復酵素遺伝子が表現できない原因になります。突然変異発生のホットポイントになります。
- 異常DNAのメチル転移複合酵素は遺伝子増幅を促進する原因であり、増幅した遺伝子が多薬耐性遺伝子であるとこの細胞は多薬耐性細胞になります。がん細胞の悪化は薬剤耐性の形成と密接な関係があり、化学療法の失敗の大部分はメチル転移複合酵素の異常に帰するといっても過言ではありません。
- がん細胞の悪化と耐薬性の獲得は、がんの自然変化の結果であり、もしDNAの合成を抗がん剤で抑制すればDNAの過メチル化はさらに進みます。化学療法が容易にガンを治せない理由はここにあります。
- 殺傷できなかった細胞はコントロール不可能な細胞になりいかなる方法をもってしてもなかなか救いようのない異常な悪性度を獲得してしまいます。
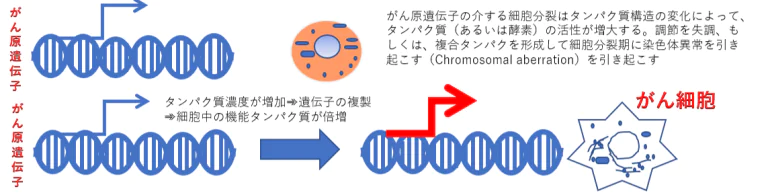
がん原遺伝子の増幅とは何か?
がん原遺伝子はシグナル伝達を引き起こす遺伝子であり、通常、翻訳されたタンパク質を介して細胞分裂のシグナルの引き金を引く
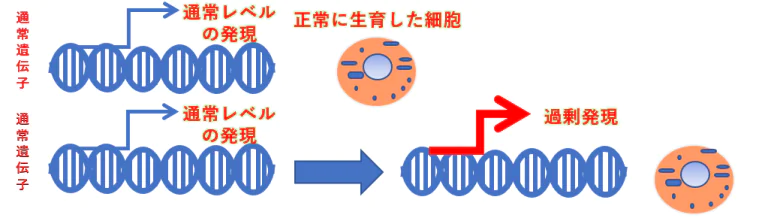
Proto-oncogenes=がん原遺伝子にコードされるタンパク質→腫瘍化タンパク(oncoproteins)は、絶え間なく増殖刺激シグナルを送り出す。その結果、がん細胞につきものの衰えることない増殖をもたらす。
主な分化誘導剤
インターフェロン
レチノール酸
ビタミンD3
「アザシチジン」=デシタビン(DNMT阻害薬)
アザシチジンは、DNAを構成する塩基の一つ「シトシン」とそっくりな化学構造をしています。そのため、がん細胞が分裂してDNAが複製される際にそのDNAの中にシトシンの代わりに取り込まれます。 「DNAメチル化酵素」がやって来ても、DNAにメチル基をくっつけることができなくなり、その結果、DNAが折りたたまれなくなります。つまり、「がんを抑える遺伝子」のスイッチがオフにならず、正常な状態を保てるというのです。
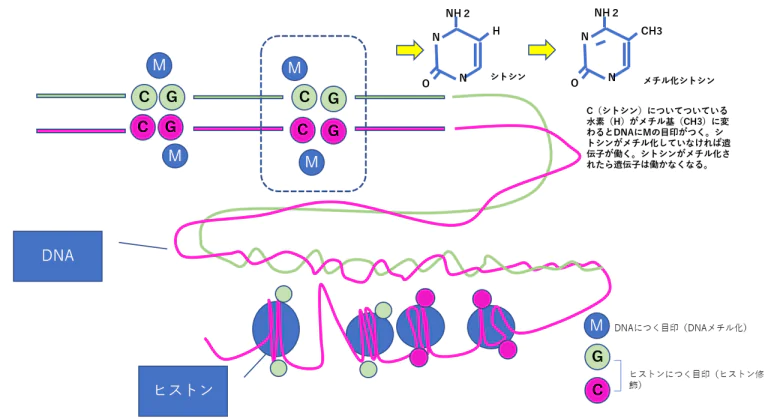
がんの細胞はDNAのメチル化に異常があることが分かっています。

・がんは、がんを抑制する遺伝子の働きによって防がれているのですが、たとえば、メチル化の異常によってがん抑制遺伝子が働かなくなり、発がんするケースもあります。このような場合は、エピジェネティクス状態を制御する薬剤によってDNAのメチル化を正常化することができれば、がんを治療することも可能になると考えられているのです。このほか、先天性疾患や統合失調症、生活習慣病などの後天性疾患、老化の制御などでもエピジェネティクス制御がかかわっているとの報告があります。
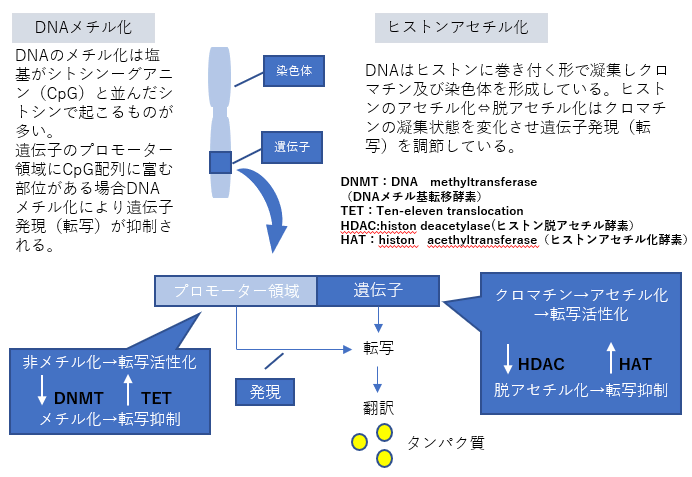
・塩基配列自体は変化していなくてもDNAやヒストンにメチル化・アセチル化などの化学的修飾が起こることによって遺伝子の発現は調節されている。これをエピジェネティック修飾という。
DNAメチル化異常を誘発する因子
- 最も古くから知られているDNAのメチル化は加齢です。その他に潰瘍性大腸炎、ウィルス感染、性ホルモン、慢性炎症、喫煙、化学物質、細菌感染、ピロリ菌、食事などもDNAメチル化の促進因子となることがわかってきています。
- DNAメチル化自体は悪いものではなく、生理的にある程度は存在しているものです。 DNAメチル化を異常に低下させるものとしてはメチル基供与体S-adenosyl-L-methine(SAM)の不足があります。
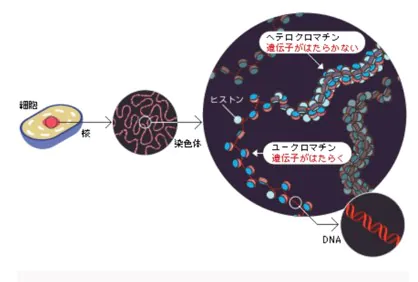
- エピジェネティクス機構には、DNAのメチル化や染色体を構成するタンパク質である「ヒストン」(DNAは「クロマチン」という構造を作って核内に収納されていますが、その時にDNAが巻き付くタンパク質のこと)のメチル化=「ヒストン修飾」などさまざまな修飾が起きており、細胞ごとに固有の修飾パターンで、遺伝子の発現に基づく細胞機能を制御しています。
- ヒストン修飾とは、ヒストンにアセチル基やメチル基などが付くことを言います。クロマチンの構造が変わることで遺伝子のオン・オフが調節されますが、その構造変化はDNAメチル化だけではなく、ヒストン修飾によっても制御されています。
- このように、染色体を構成するDNAやタンパク質が、「メチル化」や「アセチル化」などの後天的(こうてんてき)な化学修飾を受けており、この特定の細胞に固有なゲノム修飾状態全体を、「エピゲノム」と呼びます。
- 大腸がん、胃がん、乳がん等様々ながんでCpGアイランドにメチル化が多発している。この状態をCIMP (CpGアイランドメチル化形質)という。
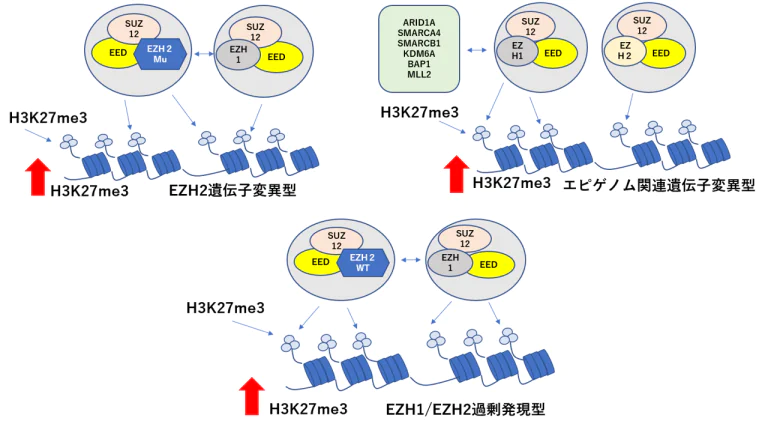
分化療法と遺伝子治療のポイント EZH2のRNA干渉によるノックダウン治療子
- メチル化ヒストン(H3K27me3)※1の異常な蓄積によるエピゲノム異常※2は、多くのがんや造血器腫瘍で見られる代表的な性質です。H3K27me3の変化によって非常に多くの遺伝子の発現パターンが変化し、腫瘍細胞の増殖能、走化/転移/浸潤能、分化異常、化学療法への耐性、宿主免疫からの逃避機構などのさまざまな特徴に対して、極めて重要な影響を及ぼすことが分かっています。
- Dこれまでに悪性リンパ腫、急性白血病などの造血器腫瘍や、乳がん、前立腺癌、肺がん、肝臓がん、膵臓がん、脳腫瘍などの多くの固形がんにおいて、H3K27me3が蓄積したエピゲノム異常が報告され、H3K27me3を誘導する複合体の中心的な酵素であるEZH2が、治療の標的となる分子の候補として研究が進んでいました。しかしながら、EZH2(※3)の遺伝子自体に異常を持たない大半の白血病、悪性リンパ腫、固形がんにおいて、H3K27me3がどのように蓄積するかは不明なままであり、高く持続的な治療効果の達成が重要な課題でした。
※1)27番目のリジン残基が3つメチル化されたヒストンH3分子。H3K27me3は近接するクロマチン構造を凝集させる働きをもつ
※2)DNAの配列の変化を伴わない後天的な遺伝子の変化を誘導する分子メカニズムの異常。エピゲノムはDNAやそれを取り巻くヒストン分子の化学修飾の総称を指す
※3)ヒストンH3の27番目のリジン残基をメチル化する酵素群。DNAの配列の変化を伴わない後天的な遺伝子の変化を誘導する。EZH1とEZH2がお互いの機能を補償して、正常細胞の機能や分化に重要であり、がん細胞でも重要な役割を果たす。がん細胞のマーカーや標的となる分子としても有名。
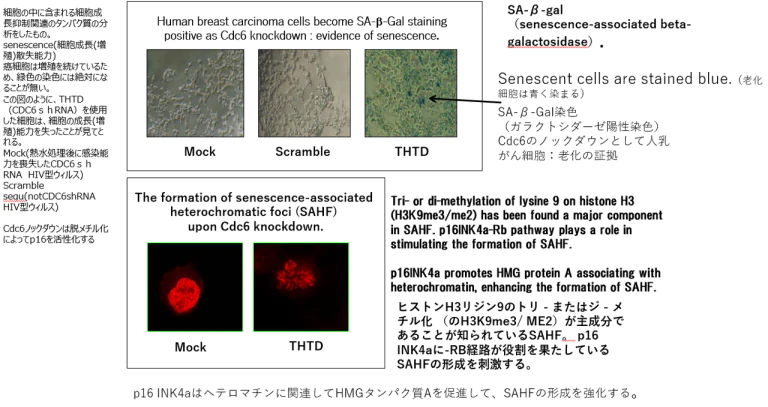
Cdc6ノックダウンによる脱メチル化